監管機構8日批准了兩種針對鐮狀細胞病的基因療法,有望治癒這種主要困擾非裔的遺傳性血液疾病。
根據美國廣播公司新聞網及美聯社的報道,食品及藥物管理局(FDA)表示,這種一次性治療可用於12歲及以上患有嚴重疾病的患者。第一種療法Casgevy由Vertex製藥公司和CRISPR治療公司聯合開發,是第一個基於基因編輯工具CRISPR獲批的療法,其發明者因CRISPR技術於2020年獲得諾貝爾獎,另一種療法Lyfgenia由Bluebird Bio開發,作用不同。這兩種基因療法是首次獲得批准針對鐮狀細胞病的基因療法。
鐮狀細胞病是一種罕見的、使人衰弱且危及生命的血液疾病。估計全國有10萬人患有鐮狀細胞病,其中約20-25%病情嚴重,患者平均壽命約為52歲。該疾病在非裔中最為常見,每365名非裔嬰兒中就有1名出生時患有這種疾病。
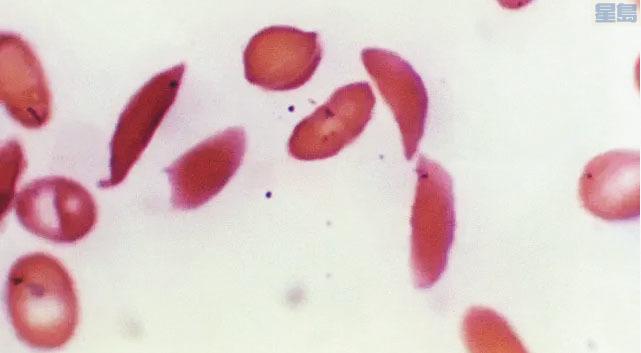
這種疾病會影響血紅蛋白,基因突變導致細胞變成鐮刀形或新月形,從而阻礙血液流動,導致難以忍受的疼痛、器官損傷、中風及其他問題。目前的療法包括藥物治療和輸血。唯一的永久解決方案是骨髓移植,需要緊密匹配的捐贈者,且可能有排斥的風險。
基因療法不需捐贈者,不是編輯掉導致鐮狀細胞疾病的基因突變,而是進行另一種編輯,促使身體開始製造健康紅血球。當患者接受治療時,幹細胞會從他們的血液中取出並送往實驗室。患者需住院數周,並接受先發性化療,可能會危及生育能力。儘管如此,許多患者稱會考慮基因療法。
這是FDA首次批准Lyfgenia;而Casgevy先前已在英國和巴林獲得授權。測試這些療法的研究表明它們效果很好。不過醫生指出,可能有副作用,長期結果尚不清楚。由於Lyfgenia已導致血癌發生,因此FDA指出標籤將包含有關該風險的「黑框警告」。
目前,Lyfgenia的標價為310萬元,而Casgevy的標價則為220萬元。為了幫助支付費用,聯邦醫療照顧和醫療補助服務中心(CMS)宣布一項計劃,旨在與州醫療補助機構和製藥公司建立合作關係。本報訊